2013年
9月24日
美国食品药品管理局(FDA)发布《医疗器械唯一标识系统最终规则》、制定UDI实施战略、推进UDI实施以来,很多国家和地区的监管机构相继启动了UDI法规的制定工作。
UDI是什么意思?
医疗器械唯一标识(UNIQUEDEVICE IDENTIFICATION,缩写UDI),是指呈现在医疗器械产品或者包装上的由数字、 字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
医疗器械唯一标识(UDI)是医疗器械的“身份证”,是唯一、精准识别医疗器械的基础,贯穿医疗器械生产、流通使用 各环节、有助于医疗器械全生命周期管理。
根据相关要求,2024年6月1日起生产的第二类医疗器械,应当具有医疗器械唯一标识。
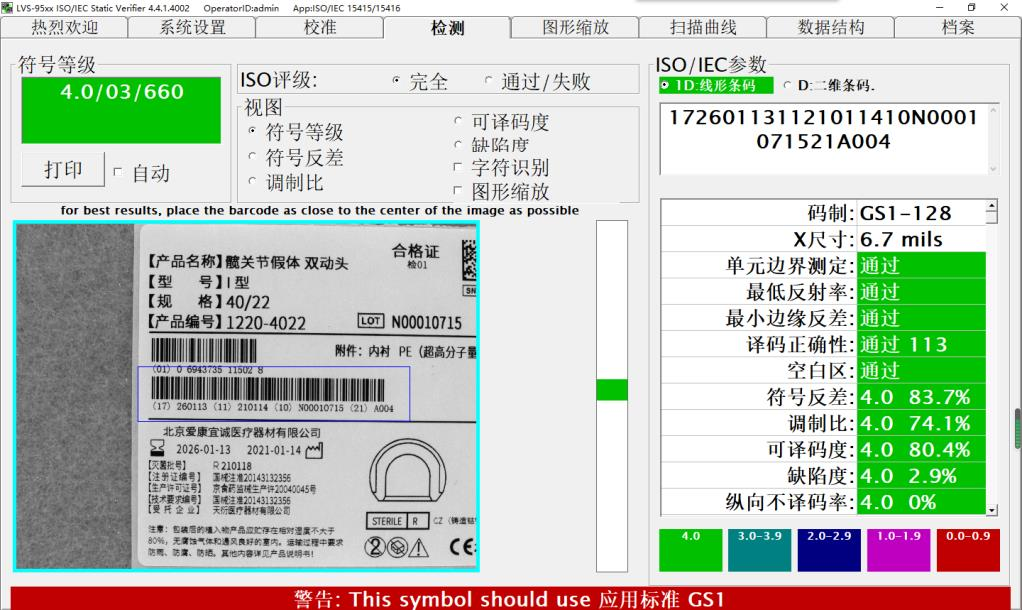
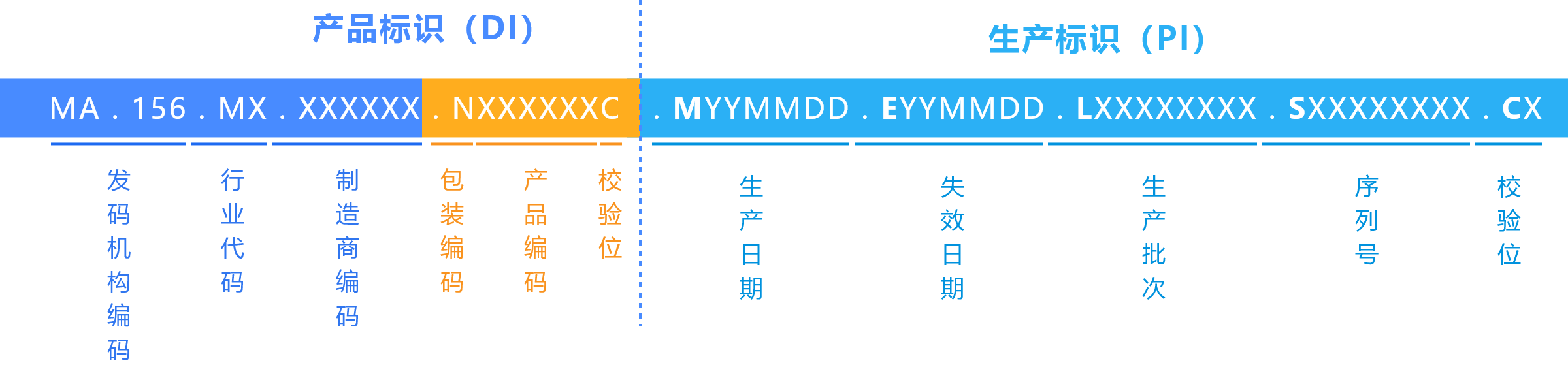
生产企业UDI编码结构


UDI历程
UDI实施流程

我们提供一站式UDI合规服务,企业无需组建UDI实施团队
企业可自由选择任意UDI服务
▪ 国内法规咨询-GS1申请注册服务、NMPA数据审核上传咨询服务、UDI合规编码指导等服务;
▪ FDA法规咨询-FDA注册/代理人服务、FDA-510K申报服务、UDI合规编码指导等服务;
▪ CE法规咨询-CE欧代申报服务、CE-PPE个人防护认证服务、UDI合规编码指导等服务。
▪ 提供UDI标签设计软件,医疗器械唯一标识管理系统,打通药监局申报、发码机构编码、追溯应用全流程;
▪ 轻松实现注册证管理、产品管理、生产管理、基础管理、系统管理。还可提供药监、医保接口服务。
▪ 提供UDI数据服务、招采前、招采后数据服务。
▪ 提供在线等级检测标签机、条码检测仪、自动喷码机、彩色标签打印机、手持式条码扫描器;
▪ 便携式数据采集器等UDI硬件设备,为医械产品提供切实可行的UDI赋码及等级检测方案。
▪ 提供适用一类、二类和三类医械企业的各种医疗设备、IVD(体外诊断)、高值耗材、低值耗材标签材料。
企业自己实施UDI难点
大公司有专门的UDI团队负责合规;中小型企业不懂UDI法规、缺乏资源、经验和资金,合规之路异常艰难
国家强制规定实施时间期限,但企业对UDI合规流程不熟悉,企业人员筹备、实施时间长
实施对生产企业的质量管理体系、器械标签管理等方面产生影响,从而增加企业管理成本
UDI实施涵盖原料入厂及检验、生产、中间品控制、成品包装、存储、运输等全流程,甚至包括产品注册信息的更新等
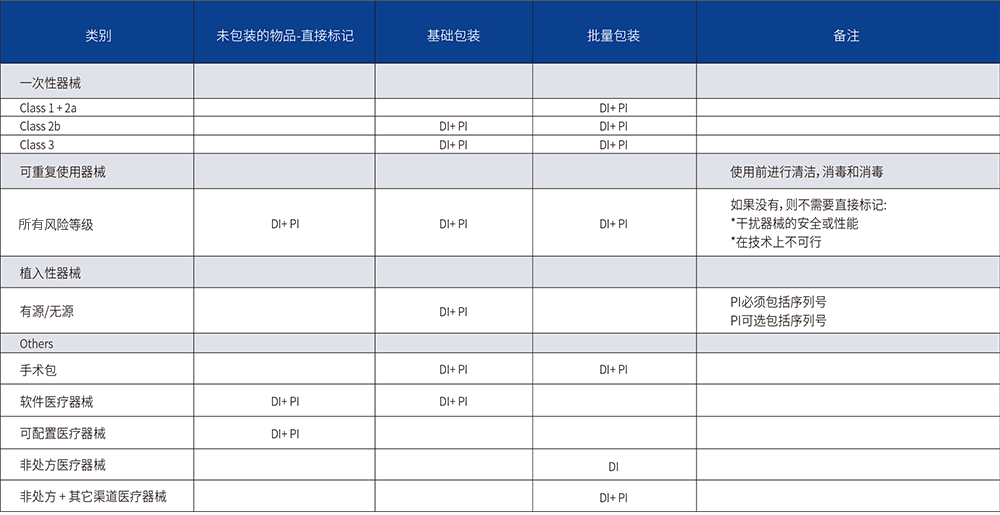
UDI标签要求
为客户服务好每一个细节,做好咨询服务工作我们企业的宗旨
UDI软件服务
UDI专家一对一实时指导,帮助梳理产品线及编码。
支持批量PI编码,支持各种方式对接主流赋码设备。
支持常规/excel/扫码换标/包装码打印等各种打印方式。
为ERP/MES等提供标准接口和定制接口对接数据。
基于UDI开放追溯、防伪、防窜等延伸应用。
支持UDI产品入库、在库、出库精细化管理。
提供UDI软件云部署或本地化部署等方式。
为UDI追溯提供生产信息
帮助企业提升管理水平,提高销售团队整体效率,降低管理成本
app,小程序,协同工作,提高工作效率,节约硬件成本

配套硬件整体方案输出
我们有咨询专家协同企业一同完成UDI方案指定,结合工厂情况,最适合的方式实现UDI的实施,软件硬件方案同时提供,免去了客户对软硬件不兼容担忧,出现后期维护时,软硬件相互扯皮影响生产的担忧。

打印设备调试
条形码,二维码检测设备调试,剔除不合格的码。